Окисление и восстановление
Содержание:
- Введение
- Виды биологического окисления
- Составление уравнений реакций окисления – восстановления
- Что такое окисление
- Процесс окисления органических веществ
- Охрана атмосферы
- Историческая справка
- Особенности реакций
- Важнейшие окислители и восстановители
- Принципы составления уравнений в органической химии
- Основные сведения о жирных кислотах
- 1.1.3 Окислительно-восстановительные свойства элементов в зависимости от строения их атомов
- Примечания
- Понятие о топливе
- Биохимия окисления жирных кислот в митохондриях
- Восстановление
Введение
С основной и изначальной точки зрения, окисление – это процесс химического характера, что сопровождается увеличением степени атомарного окисления вещества, которое ему подвергается. Это явление происходит, благодаря передаче электронов от одного атома (восстановителя и донора) до второго (акцептора и окислителя).
Данная терминологическая единица была введена в оборот химии в начале XIX века, а сделал это академик В.М. Севергин для создания обозначения, указывающего на взаимодействие веществ с кислородом из атмосферного воздуха.
В некоторых случаях окисление молекулы сопровождается созданием нестабильности в структуре вещества и приводит к его распаду на молекулы, обладающие большей стабильностью и маленькими размерами. Дело в том, что данный процесс повторяться может на нескольких разных уровнях измельчения. То есть, образованная более маленькая частица может также обладать более высокой степенью окисления, чем атомарные частички, что были исходными в том же веществе, но крупнее и стабильнее.
В химии есть понятие низшей и высшей степени окисления. Это позволяет классифицировать атомы по возможности их проявлять данное свойство. Высшая окислительная степень соответствует номеру группы, в котором находится элемент. Низшая степень, как правило, определяется по соответствию четного и нечетного числа: высшая 8 = низшая 2, высшая 7 = низшая 1.
Виды биологического окисления
В соответствии с условиями среды, в которой происходит окисление, его делят на два вида. Большинство грибков и микроорганизмов энергетические ресурсы получают путем преобразования питательного вещества посредством анаэробного способа. Данная реакция происходит без доступа молекулярного кислорода, а также ее называют гликолизом.
Более сложным способом преобразования веществ питания является аэробная форма биологического окисления или тканевого дыхания. Отсутствие кислорода вызывает неспособность клеток осуществлять окисление для получения энергии, и они гибнут.

Составление уравнений реакций окисления – восстановления
Для
составления уравнений ОВР надо знать
свойства взаимодействующих веществ,
учитывать значения окислительно-восстановительных
потенциалов (ОВП) в разных средах (глава
5.4.2), на их основании определять направление
протекания ОВР и уметь написать на этом
основании продукты реакции правой части
уравнения.
Правильно
составленное уравнение реакции является
выражением сохранения массы веществ.
Поэтому необходимо следить за тем, чтобы
количество атомов одного и того же
элемента в исходных веществах и продуктах
реакции было одинаковым. Применяют два
основных метода составления реакций
окисления-восстановления:
– метод электронного баланса;
– метод
ионно-электронного баланса (метод
полуреакций).
Что такое окисление
окисление может быть определено как потеря электронов от атома, молекулы или иона. Эта потеря электронов приводит к увеличению степени окисления химических частиц. Поскольку реакция окисления высвобождает электроны, должны быть частицы, принимающие электроны. Следовательно, реакция окисления является половинной реакцией основной реакции. Окисление химического вещества определяется как изменение его окислительных состояний. Состояние окисления это число с положительным (+) или отрицательным (-) символом, которое указывает на потерю или усиление электронов конкретным атомом, молекулой или ионом.
В прошлом термину окисление давалось определение «добавление кислорода к соединению». Это было потому, что кислород был единственным известным окислителем в то время. Однако это определение более не является точным, поскольку в отсутствие кислорода происходит гораздо больше реакций окисления. Например, реакция между магнием (Mg) и соляной кислотой (HCl) не требует кислорода, но это окислительно-восстановительная реакция, которая включает окисление Mg в Mg2+, В следующем примере показаны реакции окисления и восстановления в окислительно-восстановительной реакции.
Рисунок 01: Окисление Mg путем добавления кислорода к Mg. Два электрона высвобождаются из Mg, и один атом кислорода получает два электрона.
Есть другое историческое определение для окисления с участием водорода. То есть, окисление — это процесс потери H+ ионы, Это также не является точным, потому что есть много реакций, которые происходят без выделения H+ ионов.
Рисунок 02: Окисление спиртовой группы в карбоновую кислотную группу
Окисление всегда увеличивает степень окисления химического вещества из-за потери электронов. Эта потеря электронов вызывает изменение заряда атома или молекулы.
1. От нулевого до положительного состояния окисления
Молекула или атом, который не имеет электрического заряда (нейтральный), могут быть окислены. Окисление всегда увеличивает степень окисления. Следовательно, новая степень окисления атома будет иметь положительное значение.
Рисунок 03: окисление Fe (0) до Fe (+3)
2. От отрицательного к положительному состоянию окисления
Атом в отрицательной степени окисления может быть окислен до положительной степени окисления.
Рисунок 04: Окисление S (-2) в состояние окисления S (+6)
Рисунок 05: Окисление О (-2) до О2 (0)
4. Увеличение состояния положительного окисления
Этот тип реакций окисления в основном включен с элементами переходного металла, так как эти металлические элементы могут иметь несколько степеней окисления, и они показывают до степени окисления +7 из-за присутствия d-орбиталей.
Рисунок 06: Окисление Fe (+2) до Fe (+3)
Нейтральный атом состоит из протонов (положительно заряженных) в ядре и электронов (отрицательно заряженных) вокруг ядра. Положительный заряд ядра уравновешивается отрицательными зарядами электронов. Но когда электрон удаляется из этой системы, нет отрицательного заряда, чтобы нейтрализовать соответствующий положительный заряд. Тогда атом получает положительный заряд. Поэтому окисление всегда увеличивает положительные характеристики атомов.
Процесс окисления органических веществ
Если рассуждать логически, то раз процесс полного окисления – это горение, то процесс неполного – это окисление органики, потому что при таком воздействии происходит не воспламенение вещества, а лишь его нагревание (сопровождающееся выделением определённого количества энергии в виде АТФ – аденозинтрифосфата – и теплоты Q).
Реакция органического окисления не слишком замысловата, поэтому её начинают разбирать ещё в начале курса химии, и ученики быстро усваивают информацию, если, конечно, прикладывают хоть какие-нибудь усилия. Мы уже узнали, что это за процесс, и теперь предстоит вникнуть в саму суть дела. Итак, каким образом протекает реакция и что из себя представляет?
Это окислительно-восстановительная реакция, причём в большинстве случаев органическое вещество проявляет восстановительные свойства, а само окисляется. Для каждого задействованного элемента определена своя классификация – он либо восстановитель, либо окислитель, и мы даём название, исходя из результата ОВР.
Охрана атмосферы
В результате деятельности человека происходит загрязнение атмосферы самыми различными веществами, многие из которых ядовиты для человека, животных и растений. Изменение состава атмосферы приводит к ослаблению здоровья населения, снижению продолжительности жизни, распространению болезней. Это особенно заметно в больших городах, где атмосфера загрязняется газовыми выбросами промышленных предприятий и автомобильного транспорта.
В состав почти всех известных традиционных видов топлива входят вещества, при сгорании которых образуются не только СО2 и Н2О. При неполном сгорании топлива может образовываться весьма ядовитый угарный газ (СО). Также очень неблагоприятны для человека продукты сгорания соединений, содержащих атомы серы и азота, которыми являются оксиды серы (SO2) и азота (NO, NO2).
Для улучшения качества бензина в него добавляют соединения свинца. При сгорании такого бензина в окружающую среду выбрасывается большое количество ядовитых для человека веществ, содержащих свинец.
На сжигание различных видов топлива потребляется огромное количество кислорода. Так, в течение 1 ч. полета реактивный самолет (рис. 91) потребляет количество кислорода, вырабатываемое лесом площадью 1 га. за месяц.

Смог (рис. 92) — это туман, смешанный с пылью и сажей и содержащий продукты взаимодействия оксидов серы и азота с водой.

Кислотные дожди. Дождевая вода более кислая, чем обычная, так как в ней содержатся вещества, называемые кислотами. Они образуются при взаимодействии оксидов серы и азота с парами воды.
Парниковый эффект (рис. 93) возникает в результате повышения температуры воздуха за счет накопления в атмосфере некоторых газов, называемых парниковыми. Основным парниковым газом является углекислый газ. В результате парникового эффекта повышается температура воздуха в нижних слоях атмосферы, происходит изменение климата, возможны таяния ледников, наводнения.
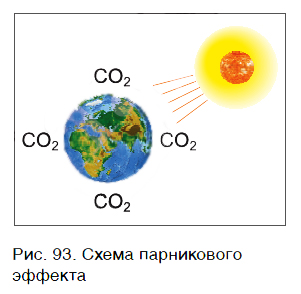
Поскольку атмосфера у всех народов Земли общая, разные государства предпринимают совместные меры по ее защите от вредных выбросов. Для этого на заводах устанавливаются очистительные установки, совершенствуются системы очистки выхлопных газов автотранспорта, разрабатываются новые экологически чистые производства и виды транспорта.
Уменьшить влияние химических веществ на природу, здоровье людей возможно, только сделав самые тщательные исследования источников и состава ядовитых соединений. Химия как наука позволяет человеку найти пути решения указанных выше проблем охраны атмосферы.
Краткие выводы урока:
- Окисление — химическая реакция, в результате которой атомы кислорода присоединяются к атомам других элементов.
- Топливо — это вещество, которое горит с выделением тепловой энергии.
- Основными видами топлива являются каменные и бурые угли, торф, древесина, нефть и природный газ.
- Сжигание различных видов топлива приводит к таким неблагоприятным последствиям, как смог, кислотные дожди и парниковый эффект.
Надеюсь урок 20 «Окислительные процессы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Историческая справка
Издавна учёные полагали, что окисление — потеря флогистона (особого невидимого горючего вещества, термин которого ввел Иоганн Бехер), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
-
- Fe+2HCl→FeCl2+H2↑{\displaystyle {\mathsf {Fe+2HCl\rightarrow FeCl_{2}+H_{2}\uparrow }}}
В этой реакции окислитель — ион водорода — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
-
- Zn+Cl2→Zn+2Cl−12{\displaystyle {\mathsf {{\stackrel {0}{\mbox{Zn}}}+{\stackrel {0}{\mbox{Cl}}}_{2}\rightarrow {\stackrel {+2}{\mbox{Zn}}}{\stackrel {-1}{\mbox{Cl}}}_{2}}}}
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Особенности реакций
Окисление ненасыщенных жирных кислот имеет некоторые особенности. Так, сложность окисления цепей с двойными связями заключается в том, что последние не могут подвергаться воздействию еноил-CoA-гидратазы из-за того, что находятся в цис-положении. Эта проблема устраняется еноил-CoA-изомеразой, благодаря которой связь приобретает транс-конфигурацию. В результате молекула становится полностью идентичной продукту первой стадии бета-окисления и может подвергаться гидратации. Участки, содержащие только одинарные связи, окисляются так же, как насыщенные кислоты.
Иногда для продолжения процесса недостаточно еноил-CoA-изомеразы. Это касается цепей, в которых присутствует конфигурация цис9-цис12 (двойные связи при 9-м и 12-м атомах углерода). Здесь помехой является не только конфигурация, но и положение двойных связей в цепи. Последнее исправляется ферментом 2,4-диеноил-CoA-редуктазой.
Важнейшие окислители и восстановители
Все химические элементы можно разделить на два больших класса — элементы с постоянными степенями окисления (такие элементы, как правило, не меняют свою степень окисления в сложных веществах), и элементы с переменной степенью окисления (такие элементы легко отдают или принимают электроны). По этой причине свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
В свою очередь, элементы с переменной степенью окисления подразделяются на три категории:
- элементы с высшей степенью окисления — такие элементы могут только понижать свою степень окисления (участвовать в процессе восстановления), следовательно, вещество, в состав которого входят такие элементы, может выступать только в роли окислителя (присоединять электроны), например, перманганат калия (марганцовка) может быть только окислителем, поскольку марганец в KMnO4 имеет высшую степень окисления +7.
- элементы с низшей степенью окисления — такие элементы могут только повышать свою степень окисления (участвовать в процесс окисления), следовательно, вещество, в состав которого входят такие элементы, может выступать только в роли восстановителя (отдавать электроны), например, аммиак является восстановителем, поскольку, азот, входящий в состав NH3, имеет низшую степень окисления -3.
- элементы с промежуточной степенью окисления — такие элементы могут, как отдавать электроны, так и принимать их (все зависит от «партнера» по реакции), следовательно, вещество, в состав которого входят такие элементы, может быть, как окислителем, так и восстановителем, например, сера, входящая в состав сульфита натрия Na2SO3, имеет промежуточную степень окисления +4, по этой причине сульфит натрия в реакции с перманганатом калия окисляется до сульфата натрия (является восстановителем), а в реакции с сероводородом сульфит натрия восстанавливается до свободной серы (является окислителем).
Активные окислители:
- простые вещества:
- кислород (O2);
- фтор (F2);
- сложные вещества:
- перманганат калия (KMnO4);
- хроматы и дихроматы (K2Cr2O7);
- азотная кислота и ее соли (HNO3);
- хлорная кислота и ее соли (HClO4);
- концентрированная серная кислота (H2SO4);
- оксид свинца (PbO2).
Активные восстановители:
- все простые вещества-металлы, наиболее активные:
- щелочные металлы;
- щелочноземельные металлы;
- магний (Mg);
- алюминий (Al);
- цинк (Zn).
- сложные вещества:
- метан (CH4);
- аммиак(NH3);
- силан(SiH4);
- фосфин(PH3);
- нитриды и фосфиды металлов (Na3N, Ca3P2)
- сероводород (H2S)
- галогеноводороды (HI, HBr, HCl)
- сульфиды и галогениды металлов
- гидриды металлов (NaH, CaH2)
промежуточной степенью окисления
- чаще являются окислителями:
- галогены (Cl2; Br2);
- хлорноватистая кислота (HClO) и ее соли (гипохлораты, хлораты);
- оксид марганца (IV) MnO2;
- соли трехвалентного железа (FeCl3)
- чаще являются восстановителями:
- водород (H2);
- углерод (C);
- оксид углерода (II) CO;
- сульфиты металлов (Na2SO3);
- соли двухвалентного железа (FeSO4)
Разновидности окислительно-восстановительных реакций:
-
межмолекулярные — окислитель и восстановитель являются разными веществами:
N2+H2→N-3H3+1
-
внутримолекулярные — окислитель и восстановитель входят в состав одного вещества:
N-3H4N+3O2→N2+H2O
-
реакции диспропорционирования — окисляется и восстанавливается один и тот же элемент, находящийся в промежуточной степени окисления:
N+4O2+H2O→HN+5O3+3+HNO2
Принципы составления уравнений в органической химии
В химии не обходится без составления уравнения – это своего рода язык данной науки, на котором могут говорить все учёные планеты независимо от национальности и понимать друг друга.
Однако наибольшие трудности вызывает составление уравнений, когда предстоит изучение органической химии.
Для разборки этой темы требуется очень большой промежуток времени, поэтому здесь подобран лишь краткий алгоритм действий для решения цепочки уравнений с некоторыми пояснениями:
- Во-первых, мы сразу смотрим, сколько реакций протекает в данном процессе, нумеруем их. Также определяем классы, названия веществ исходных и веществ, которые в итоге образуются;
- Во-вторых, необходимо поочерёдно выписать все уравнения и узнать тип их реакций (соединение, разложение, обмен, замещение) и условия.
- После этого можно составить электронный балансы, а также не забываем расставлять коэффициенты.
Основные сведения о жирных кислотах
Жирные кислоты представляют собой углеродные цепи различной длины (от 4 до 36 атомов), которых по химической природе относят к карбоновым кислотам. Эти цепи могут быть как разветвленными, так и не разветвленными и содержать разное количество двойных связей. Если последние полностью отсутствуют, жирные кислоты называют насыщенными (характерно для многих липидов животного происхождения), а в противном случае — ненасыщенными. По расположению двойных связей жирные кислоты подразделяют на мононенасыщенные и полиненасыщенные.
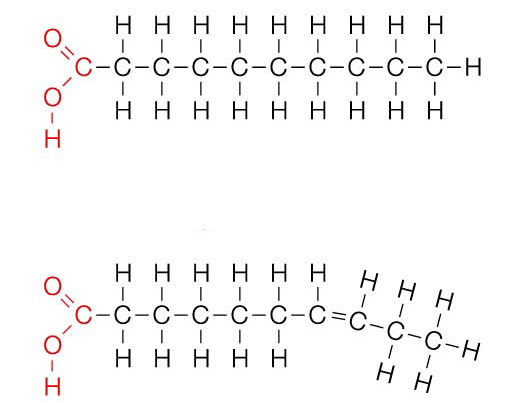
Большинство цепей содержит четное число атомов углерода, что связано с особенностью их синтеза. Однако есть соединения с нечетным количеством звеньев. Окисление этих двух типов соединений несколько отличается.
1.1.3 Окислительно-восстановительные свойства элементов в зависимости от строения их атомов
Способность
химических элементов присоединять или
отдавать электроны связана со строением
атомов и их положением в периодической
системе элементов Д. И. Менделеева.
Атомы
металлов в химических реакциях способны
лишь отдавать электроны и быть
восстановителями.
К
металлическим элементам относятся:
элементы 1-2 групп; элементы 3-12 групп, а
также лантаниды и актиниды; элементы
13 группы, кроме бора; элементы 14 группы,
кроме углерода и кремния; элементы 15
группы, кроме азота, фосфора и мышьяка.
Атомы металлических элементов содержат
на внешнем уровне один, два, три электрона.
Наиболее
активными восстановителями являются
щелочные и щелочноземельные металлы,
среди которых самый активный – франций.
Мерой восстановительной активности
металлов является энергия ионизации.
Для
неметаллов: F,Cl,Br,I,At,O,S,Se,Te,N,P,As,C,Si,B,Hболее
характерно присоединение электронов.
Атомы неметаллов, за исключением водорода
и бора, на внешнем энергетическом уровне
имеют четыре, пять, шесть, семь электронов.
Наиболее
активно присоединяют электроны атомы
фтора, который, имея самую высокую
электроотрицательность, является
сильным окислителем. За ним по окислительной
способности идёт кислород, атомы которого
могут отдавать электроны только атомам
фтора. Другие неметаллы могут не только
принимать, но и отдавать электроны, а
значит, проявляют не только окислительные,
но и восстановительные свойства, которые
выражены много слабее. Мерой окислительной
способности атома является величина,
называемая сродством к электрону.
Относительно
окислительно-восстановительных свойств
ионов можно сказать следующее. Катионы
щелочных и щелочноземельных металлов
почти не проявляют окислительных
свойств. Напротив, катионы малоактивных
металлов в высшей степени окисления
являются окислителями, например Fe3+.
Катионы металлов в промежуточной или
минимальной степени окисления
преимущественно проявляют восстановительные
свойства, напримерFe2+.
Отрицательно
заряжённые ионы неметаллов (Cl-,S2-,N3-и другие) проявляют только восстановительные
свойства.
Например:
S2— 2ē →S
В
пределах каждого периода с возрастанием
порядкового номера элементов их
восстановительная способность понижается,
а окислительная — возрастает. Так, во
втором периоде литий — только восстановитель,
а фтор – только окислитель. Это результат
возрастания заряда ядра атомов, уменьшения
радиуса атомов и постепенного заполнения
электронами внешнего энергетического
уровня (у атома лития один электрон, у
атома фтора их семь). Энергия ионизации
при этом возрастает, и также возрастает
сродство к электрону.
В
пределах каждой группы s-
иp-элементов с возрастанием
порядкового номера элементов
восстановительная способность их атомов
возрастает, а окислительная способность
убывает. Так, в 16 группе кислород –
сильный окислитель, а теллур – очень
слабый окислитель и в некоторых реакциях
проявляет даже свойства восстановителя.
Эти закономерности обусловлены
увеличением радиуса атомов элементов,
в связи с чем уменьшается энергия
ионизации и сродство к электрону.
Примечания
- В этом, как и во многих других случаях водород рассматривают как помещённый в VII группе периодической системы химических элементов над галогенами-окислителями.
- Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется в виду в том числе и валентности.
- (недоступная ссылка). Химия и химическая технология в жизни (10.07.2013). Дата обращения 19 января 2015.
Понятие о топливе
Процессы горения издавна используются для удовлетворения нужд человека в энергии и тепле.
Топливо — это вещество, которое горит с выделением тепловой энергии.
По агрегатному состоянию топливо бывает твердое, жидкое и газообразное.
Запасы топлива могут быть восполнимыми (древесина, древесный уголь) и невосполнимыми (уголь, торф, нефть).
Каменные и бурые угли. Уголь (рис. 87) является древнейшим источником энергии, с которым знакомо человечество. Он представляет собой полезное ископаемое, которое образовалось из растительного материала на протяжении многих миллионов лет. Например, древесина без доступа воздуха превращается в каменный уголь. Основная масса угля состоит из углерода и органических соединений.

Торф
В Беларуси важное значение для бытового отопления и работы небольших предприятий имеет торф (рис. 88)
Это топливо, которое образуется без доступа воздуха на низинных болотах из мха сфагнума и другой растительности. В последнее время его спрессовывают с угольной крошкой и получают торфоугольные брикеты, которые также используются как топливо.

Древесина
Нефть. Источник самых разнообразных жидких видов топлива на Земле — нефть (рис. 89). При ее переработке получают такие важные виды горючего, как бензин, керосин, лигроин, мазут. Эти виды топлива используются в автомобилях и тракторах, реактивных авиационных двигателях, а также на тепловых электростанциях и в системах теплообеспечения жилья и предприятий.

Природный газ. Примерно на 90 % состоит из метана CH4. Использовать его в качестве топлива стали только в XX в. Сегодня наша жизнь немыслима без газопроводов (рис. 90), доставляющих «голубое топливо» в наши квартиры, на ТЭС, ТЭЦ, промышленные предприятия.

Биохимия окисления жирных кислот в митохондриях
Для удобства процесс митохондриального катаболизма условно подразделяется на 3 этапа:
- активация и транспортировка в митохондрии;
- окисление;
- окисление образовавшегося ацетил-коэнзима А через цикл Кребса и электротранспортную цепь.
Активация представляет собой подготовительный процесс, который переводит жирные кислоты в форму, доступную для биохимических превращений, так как сами по себе эти молекулы инертны. Кроме того, без активации они не могут проникнуть в мембраны митохондрий. Эта стадия протекает у внешней мембраны митохондрий.
Собственно, окисление — ключевой этап процесса. Оно включает четыре стадии, по окончании которых жирная кислота превращается в молекулы Ацетил-КоА. Тот же продукт образуется и при утилизации углеводов, так что дальнейшие этапы аналогичны последним стадиям аэробного гликолиза. Образование АТФ происходит в цепи переноса электронов, где энергия электрохимического потенциала используется для образования макроэргической связи.
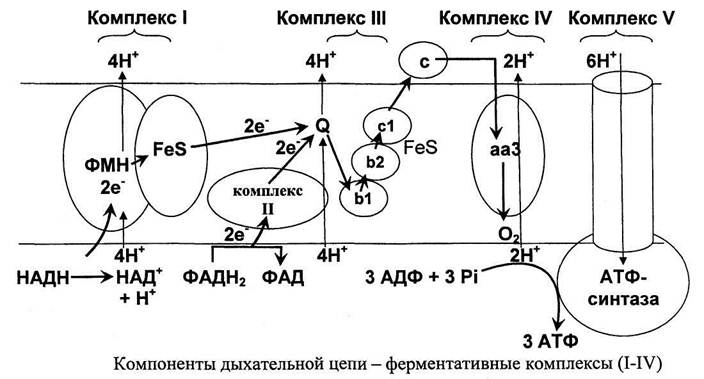
В процессе окисления жирной кислоты кроме Ацетил-КоА образуются также молекулы NADH и FADH2, которые тоже поступают в дыхательную цепь в качестве доноров электронов. В результате суммарный энергетический выход катаболизма липидов достаточно высок. Так, к примеру, окисление пальмитиновой кислоты по β-механизму дает 106 молекул АТФ.
Восстановление
Восстановительные реакции бывают трех типов:
- получение электронов;
- потеря атомов кислорода;
- получение атомов водорода.
Получение электронов
Восстановление — химическая реакция во время которой химический элемент получает электроны:
Ag+ + e- → Ag(т)
Во время гальванопокрытия катион серебра (положительнозаряженный ион) получает электрон и восстанавливается до металлического серебра.
Потеря кислорода
В некоторых реакциях восстановление осуществляется за счет потери атомов кислорода:
Fe2O3 (т) + 3CO(г) → 2Fe(т) + 3CO2 (т)
Железная руда восстанавливается до металлического железа при помощи реакции взаимодействия с оксидом углерода.
Получение водорода
В некоторых случаях восстановление происходит в результате получения атомов водорода:
CO(г) + 2H2 (г) → CH3OH(ж)
Молекула оксида углерода получает атомы водорода и становится метиловым спиртом.






